
Frank van Hertrooij
Scivolemo 19 Septembro 2018
Pliaj artikoloj

Malkovri novan elementon ne estas facila. En pluraj lokoj surtere estas gigantaj maŝinoj,kaj homoj, kiuj laboras ĉiutage por plenigi la periodan tabelon. Antaŭ ducent jaroj tiu tasko estis multe pli aventura. Oni neniam sciis kiam oni trovus novan elementon. En la moderna perioda tabelo eĉ estas kvar elementoj, kies nomo venas de la sama minejo en Svedio. Tie, ĉiuj el ili estis malkovritaj, kune kun kelkaj aliaj elementoj, inter 1843 kaj 1879. Dume, la novaj elementoj rapide ekhavis rolojn en produktoj kaj la industrio. Malkovri elementojn do ne estis kolektado de poŝtmarkoj por sciencistoj, sed havis gravan praktikan utilon. Hodiaŭ ne plu havas sencon serĉi novajn elementojn en la Tero. Ĉiuj elementoj, kiuj nature troveblas surtere estas konataj kaj oni nur povas malkovri novajn elementojn per mem krei ilin. Kiel oni do povas scii ke oni trovis ĉiujn? Kiom da elementoj eĉ ekzistas? La respondoj kaŝas sin en la strukturo de la atomo.

Kelkaj elementoj, kiel oro, jam estis konataj dum miljaroj. Aliaj elementoj estis tiom reagemaj, ke oni bezonis tre ruzan ĥemion por izoli ilin. Aldone estis elementoj tiom maloftaj, ke oni devus traserĉi la tutan teron por ili. Ĉiu elemento havis sian propran rakonton kaj ekzistas tro da elementoj por priskribi ilin ĉiujn. La rakonto komenciĝis tamen kun fosforo, la unua elemento kiu estis malkovrita post antikvaj tempoj.

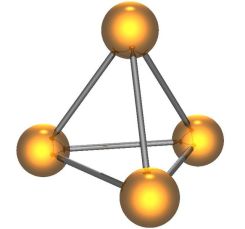
Elemento estas substanco, kiun oni ne povas disigi ĥemie. Akvo, ekzemple, ne estas elemento, pro tio ke oni povas disigi ĝin. La rezulto de tiu reago estas hidrogeno kaj oksigeno, kiuj ja estas elementoj. En la naturo estas tre multaj fontoj de fosforo. Ĝi troviĝas subtere kaj en ĉiuj vivantaj organismoj. Ĝi fakte havas esencan rolon en gravaj biologiaj molekuloj kiel DNA kaj ATP. Kiel normala parto de la digestado, ankaŭ urino enhavas molekulojn, kiuj enhavas fosforon. Feliĉe estis alĥemiisto, kiu ne timis labori kun tiaj rimedoj. Kiam la Germano Hennig Brand malkovris fosforon en 1669, li ne interesiĝis pri digestado tamen. Kvankam li uzis ĥemiajn reagojn por liaj eksperimentoj, li estis alĥemiisto kaj serĉis manieron por krei oron. Oni nun scias ke oni ne povas ĥemie krei oron el aliaj metaloj, ĉar oro estas elemento, sed tiam oni ankoraŭ ne sciis tion. La origina recepto de Brand ne estis la plej agrabla eksperimento. Unue, li lasis la urinon dum kelkaj tagoj, ĝis ĝi ekhavis teruran odoron. Post tio, li boligis la urinon ĝis la restaĵoj formis blankan paston. Laste, li uzis akvon por kondensi la vaporojn, kiuj eliris el la varma pasto, esperante ke la kondensaĵo estus oro. Anstataŭe, li produktis blankan, solidan ĥemiaĵon, kiu brilis en mallumo. Brand origine pensis ke li sukcesis krei la Ŝtonon de la Saĝuloj, kiu laŭ la legendoj ŝanĝus kutimajn metalojn al oro, sed tio, kion li fakte kreis estis blanka fosforo: molekulo, kiu konsistas el kvar fosforaj atomoj en la formo de piramido. Malgraŭ la klopodoj de Brand, la nova elemento ne estis la Ŝtono de la Saĝuloj, do finfine li vendis la recepton. La elemento estas tre utila tamen kaj poste estis uzata por ĉio de sterko ĝis bomboj.
Post fosforo ankaŭ aliaj elementoj estis malkovrataj. Dume, oni pli kaj pli bone komprenis tion, kion oni faris kaj alĥemio estis anstataŭigata de vera ĥemio. Kio mankis tamen, estis strukturo por ordigi ĉiujn elementojn. Tio estis granda defio, ĉar solvi puzlon estas malfacila kiam oni ne havas ĉiujn pecojn. Aldone, oni komprenis preskaŭ nenion pri la ena strukturo de atomoj. Eble la unua serioza propono por ordigi la elementojn estis la ”triopoj de Döbereiner”. Observinte la similecon inter bario, stroncio kaj kalcio en 1817 kaj poste aliaj elementoj, li trovis kelkajn triopojn. Liaj triopoj estis grupoj de tri elementoj, kiuj agis simile en reagoj. Aldone, li rimarkis ke la averaĝo de la atomaj masoj de du el la elementoj donas la atoman mason de la tria. La sistemo ne iĝis tre populara, pro tio ke ĝi ne sufiĉe bone aplikeblis al ĉiuj elementoj. Ke li kategoriigis elementojn laŭ iliaj ĥemiaj kvalitoj kaj ke li iel ligis tion al maso jam estis bonaj paŝoj antaŭen, tamen. En la moderna perioda tabelo, oni fakte ankoraŭ vidas ke la triopoj, kiel ĥloro (Cl), bromo (Br) kaj jodo (I) troviĝas unu sub la alia en la tabelo. La bazo estis tie, sed por la sekva paŝo, oni devis atendi kelkajn jarojn.
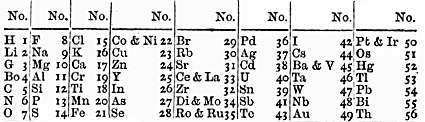
La sekva signifa provo de organizi la elementojn okazis en 1864, kiam la Anglo John Newlands proponis sian ”leĝon de oktoj”. Li listigis ĉiujn elementojn, kiuj tiam estis konataj kaj metis ilin en tabelo. Same kiel muziknotoj, li vidis ke ankaŭ la ĥemiaj kvalitoj de la elementoj ripetiĝis ĉiam post ok paŝoj. Por la unuaj elementoj, lia sistemo funkciis tre bone, sed ne post kalcio. Oni vidas ekzemple, ke laŭ lia sistemo, fero devus havi similajn kvalitojn kiel oksigeno kaj sulfuro. Kompreneble fero estas tre malsimila, interalie pro tio ke ĝi estas metalo, do la sistemo de Newlands ne estis akceptata de la ĥemia komunumo. Malgraŭ tio, oni jam povas vidi multajn similecojn inter la tabelo de Newlands kaj la moderna perioda tabelo.

La sekva ĥemiisto, Dmitrij Mendelejev (Дмитрій Ивановичъ Менделѣевъ), estas plej ofte rigardata kiel la elpensinto de la perioda tabelo. La tabelo, kiun li publikigis en 1869, ŝajne estis bazita sur paciencludo. Mendelejev tiel ordigis la 65 konatajn elementojn, ke la atoma maso ĉiam kreskis de maldekstre dekstren. Aldone, li ordigis ilin tiel, ke similaj elementoj estu unu sub la alia. Tio tre similas al tio, kion Newlands faris, sed kun la gravega diferenco ke la tabelo de Mendelejev havis truojn. Ĉi tio ne estis eraro kaj Mendelejev konsciis pri tio. Laŭ li, la truoj devis esti la lokoj de elementoj, kiujn oni ankoraŭ ne malkovris. Per rigardi kie en la tabelo la truoj situis, li povis antaŭvidi kiom granda la maso de la elemento devus esti kaj kiaj la ĥemiaj kvalitoj estus. Science tio estis tre valora, ĉar oni povis konfirmi ke la sistemo havas sencon per malkovri la elementojn. Kelkaj el tiuj elementoj estis trovataj kaj aldonataj al la tabelo poste, sed la tabelo ankoraŭ ne estis kompleta.

Same kiel fosforo, elementoj estis malkovrataj pere de ĥemio tiutempe. Oni devis disigi pli grandajn molekulojn por trovi la elementojn el kiuj ili estis faritaj. Tio funkcias por la plejparto de elementoj, sed la noblaj gasoj ne aŭskultas. Sub normalaj kondiĉoj, ili reagas kun nenio kaj nur troveblas kiel gasoj el apartaj, solaj atomoj. Tiutempe oni jam konis nereagemajn elementojn, kiel oron, sed noblaj gasoj ne havas koloron aŭ odoron, do trovi ilin estas multe malpli facila. La Skoto William Ramsay ŝanĝis tion. Lia laboro estis la preciza mezurado de la fizikaj ecoj de gasoj kaj likvaĵoj. En 1894, li aŭdis de Lord Rayleigh, kiu laboris kiel profesoro de fiziko en la Cavendish laboratorio inter 1879 kaj 1884, ke li suspektis la ekziston de nekonata gaso, ĉar laŭ liaj mezuroj, atmosfera nitrogeno estis ĉirkaŭ 0,05% pli densa ol la nitrogeno, kiu venis el ĥemiaj reagoj. Ankaŭ Cavendish notis ke iom da gaso restas kiam oni ĥemie forigas ĉiujn tiam konatajn gasojn el aero. Rayleigh kaj Ramsay decidis kunlabori kaj Ramsay sukcesis izoligi la gason per lasi la nitrogenan gason en la atmosfero reagi kun varmega magnezio, kreante magnezian nitraton. La restanta gaso estis tute nereagema kaj la duopo anoncis sian malkovron de la nova elemento: argono. En 1895, Ramsay aŭdis pri nova mistera gaso. Ŝtonoj kiuj enhavis multe da uranio ellasis strangan, nereageman gason. Unue, oni pensis ke la gaso estis nitrogeno, sed per preciza analizo, Ramsay ekskludis ĉiujn konatajn gasojn krom argonon. Argonon tamen, havis malsaman spektron (oni povas identigi gasojn laŭ kiuj partoj de la spektro de lumo ili absorbas). Ene de semajno, li konfirmis ke la mistera gaso estis heliumo, gaso kiu antaŭe estis nur trovata en la Suno (denove, per analizi la lumon) en 1868. En marto de 1895, Ramsay diskonigis sian malkovron al la ĥemia societo de Londono, sed li ankoraŭ ne estis kontenta. Komprenante ke la noblaj gasoj estis nova grupo en la perioda tabelo, li laboris por trovi la restantajn gasojn. Tio ne facilis tamen, ĉar, krom argono, noblaj gasoj estas maloftaj en la atmosfero. Kiel maljunulo, Mendelejev aldonis la novan grupon al la perioda tabelo. Malkiel la moderna tabelo, kiun oni vidas en klasĉambroj, lia tabelo enhavis la noblajn gasojn plej maldekstre. Mendelejev ankoraŭ ne kredis ke hidrogeno estas la malplej peza elemento kiu ekzistas, do li metis heliumon apud lition. Tiel oni povus poste meti novan elementon apud hidrogenon, super heliumon.
La tabelo de Mendelejev estis preskaŭ ĝusta, sed ĝi havis unu gravan eraron. Foje, la reguloj pri atoma maso kaj ĥemia simileco ne tute funkciis. La atoma maso de teluro estas pli alta ol tiu de jodo, do ĝi devus esti dekstre de jodo en la tabelo, sed kiam oni rigardas iliajn ĥemiajn kvalitojn, ili devus esti inversaj, por ke ili estu en la ĝustaj grupoj. La problemo estas ke la periodeco de elemento ne rilatas al atoma maso, sed al atomnumero. Tiu numero indikas kiom da protonoj (kaj elektronoj) troviĝas en la atomo. Oni ankoraŭ ne sufiĉe komprenis la enan strukturon de atomoj en la tempo de Mendelejev tamen, do oni ne povas akuzi lin. Poste estis la Brito Henry Moseley, kiu proponis organizi la elementojn laŭ iliaj atomnumeroj kaj tiel solvis problemojn kiel tiujn pri jodo kaj teluro. Post lia kontribuo, la perioda tabelo aspektis preskaŭ tute kiel tiu de hodiaŭ. La nuntempa versio nur havas iom pli da elementoj.
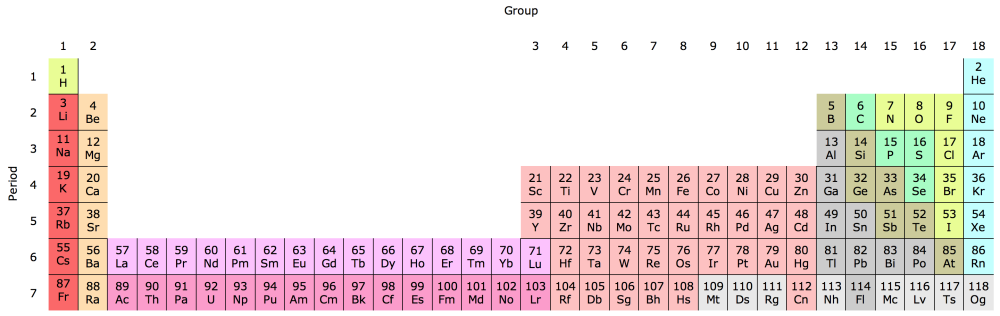
Hodiaŭ, oni scias multe pli pri la strukturo de atomoj kaj molekuloj. Atomoj havas kernon (aŭ nukleo), kun partikloj kun pozitiva ŝarĝo (protonoj) kaj neŭtralajn partiklojn (neŭtronojn), kiuj funkcias iom kiel gluo. Ekster la kerno estas la elektronoj, kiuj havas negativan ŝarĝon. La elektronoj estas gravegaj, ĉar ili necesas por krei ĥemiajn ligojn. Kiom da elektronoj la atomo havas kaj kiel ili estas strukturitaj do difinas la ĥemiajn kvalitojn de la elemento. Pere de la hodiaŭa kompreno de kvantummeĥaniko, oni eĉ povas matematike priskribi tiun elektronan strukturon, kio certigas ke oni trovis ĉiujn elementojn, kiuj povas ekzisti en naturo. Ne ĉiuj elementoj, kiujn oni povas priskribi, ekzistas en la naturo, pro tio ke pezaj elementoj estas nestabilaj. Pro la pozitivaj ŝarĝoj en la kerno, atomoj emas disfali kaj oni bezonas la neŭtronojn por preventi tion. Pli pezaj elementoj havas pli kaj pli da neŭtronoj, sed ili ne helpas senfine. Tio kaŭzas nestabilecon kaj multaj elementoj spontane disfalas. Tiu efiko nomiĝas radioaktiveco kaj la plej konata ekzemplo estas tiu de uranio (kiam ĝi disfalas, unu el la produktoj estas heliumo, kio klarigas tion, kion Ramsay detektis). Multaj pli pezaj elementoj estas eĉ tiom nestabilaj ke ili disfalas ene de sekundo aŭ eĉ malpli. Tio signifas ke oni nur povas malkovri pli pezajn elementojn per mem krei ilin. Kiel antaŭe dirite, oni ne povas krei elementojn per ĥemiaj reagoj, sed ja per nukleaj reagoj. Tion steloj faras la tutan tempon. Homoj ne uzas stelon por tiu celo, sed partiklajn akcelilojn. En la akcelilo, oni pafas etajn atomkernojn kontraŭ pli grandan atomkernon, ĝis unu el ili trafas ĝin. Tiam la nova elemento kreiĝas kaj preskaŭ tuj disfalas. Pro tio ke oni ne povas simple kunporti la novan elementon en tubeto, la konfirmado de ĉi tiaj elementoj estas multe malpli simpla. Pluraj teamoj serĉas la novajn elementojn samtempe en malsamaj lokoj surtere kaj oni devas analizi multajn datumojn por scii, ĉu la mezuroj estis ĝustaj.
La lastaj elementoj kiuj estis malkovrataj estis nihonio (Nh), moskovio (Mc), teneso (Ts) kaj oganesono (Og) kun la nombroj 113, 115, 117 kaj 118. Ili estis malkovrataj dum la periodo inter 2002 kaj 2009 kaj ricevis oficialajn nomojn la saman tagon en 2016. Oganesono estas la lasta elemento en sia periodo, kio igas la tabelon aspekti kompleta. Malgraŭ tio, sciencistoj fidas ke ili trovos la elementojn 119 kaj 120, sed ili ja frontas kontraŭ teĥnikaj defioj. Por krei la novajn elementojn, oni bezonas malpezan elementon kiel ĵetaĵon kaj grandan elementon kiel celon. Por la lastaj elementoj oni uzis maloftan izotopon de kalcio kun atoma maso de 48. Se oni daŭre volus uzi kalcion kiel ĵetaĵon por krei elementon 119, la celo devus esti ejnŝtejnio, sed produkti tion estas ege malfacila kaj multekosta kaj la celo devus esti malpli granda ol tiuj, kiujn oni uzas nun. Alternative oni povus uzi pli pezan ĵetaĵon, sed tiam oni bezonas pli forte ĵeti ĝin. Oni forte laboras tamen kaj verŝajne trovos la elementon, ĉu en du jaroj, ĉu en dek. Ĉi tiuj eksperimentoj ne estas facilaj, sed ili estas tre gravaj por scienco. Ili ne nur estas kialo por elpensi eĉ pli detalajn mezurilojn, sed ankaŭ helpas onin trovi respondojn al tre fundamentaj demandoj pri kio atomoj estas kaj kiel ili estas strukturitaj. En mondo kiu preskaŭ tute konsistas el atomoj, tio estas bona afero por scii.